
产品货号:
GS0256
中文名称:
细胞活性检测试剂盒(双荧光染色)
英文名称:
Cell Viability Assay Kit,Green/Red Dual Fluorescence
产品规格:
2×96T
发货周期:
1~3天
产品价格:
询价
本试剂盒基于CytoCalcein Green和PI双染法检测细胞活力,CytoCalcein Green是一种疏水性复合物,可以轻易地渗透进入完整的活细胞,通过酯酶的水解作用,产生强烈的荧光。通过细胞内酯酶水解非荧光性CytoCalcein Green,形成具有强烈荧光的亲水性Calcein,并且保留在细胞质中。这种酯酶的活性与活细胞数量成比例关系。DNA结合染料极性非常大,不能渗透进入具有完整细胞膜的活细胞,它只有在与死细胞的DNA结合的情况下才发出荧光。生长在培养板中的细胞可以被染料,且在不到两小时内就可以完成定量分析。本检测法比其它活细胞检测法更加强大、稳定。它可以用于许多荧光实验平台的高通量分析中,例如微孔板分析,免疫组化和流式细胞术。本试剂盒提供所有必需组分和最佳检测方案。它适合于增殖型和非增殖型细胞,也可用于悬浮和贴壁细胞。

| 组分 | 规格 |
| 组分A:CytoCalcein Green | 2支 |
| 组分B:碘化丙啶(10mM) | 40μL |
| 组分C:DMSO | 100μL |
| 组分D:检测缓冲液 | 20mL |
保存:-20℃,避光

使用前,请将该试剂盒的所有组分在室温下解冻。
- 在侧壁暗色底部透亮的多孔细胞板中,细胞计数,每孔铺100到10000个细胞,每个细胞孔中加入待测的化合物,在细胞培养箱中,孵育所需要的时间(比如24,48,或96个小时)。对于空白对照孔(不含细胞的培养基),加入等量的待测物缓冲液。对于96孔,建议细胞培养板每孔总体积为100μL,384细胞微量板,建议细胞培养板每孔总体积为25μL。
- 细胞培养板中每株细胞的最佳浓度,是基于实验目的检测细胞增殖或是检测细胞毒性的不同,对于细胞增殖检测,每孔细胞浓度要尽量低,对于细胞毒性检测,每孔细胞初始浓度要尽量高。
- 加20μL DMSO (组分C)至一支CytoCalcein Green(组分A)中,充分混匀。
- 20μL的CytoCalcein Green储备液量足够一个板使用,未用的CytoCalcein Green染料储存液储存于密闭的管子里,低于-20℃冷冻,避光,可保存一个月,期间应避免反复冻融。
- 将CytoCalcein Green储备液20μL和碘化丙锭(组分B)20μL加入至10mL的检测缓冲液(组份D),混匀,此染色工作液室温下至少能稳定保存2小时。
- 如果细胞如CHO细胞中含有的有机阴离子转运蛋白,该蛋白随时间的延长可促进荧光染料渗漏,需要在加样缓冲液中加入丙磺舒储备溶液,丙磺舒工作浓度范围为1?2.5mM。未使用的丙磺舒储备溶液需要分装并冻存于温度低于-20℃的冰箱。由于最佳的染色条件可能因不同的细胞类型而有所不同,因此建议分别确定组分A和组分B的合适浓度。
- 根据需要(步骤1)用测试混合物处理细胞。
- 加反应混合物之前不需要冲洗细胞。然而如果测试混合物对血清敏感,生长培养基和血清因子在加入测试混合物之前需要除去。吸取培养基后,每孔加入HHBS(含20mM Hepes的Hanks缓冲液),96孔板每孔加入100μL,384孔板每孔加入25μL,或者是使用无血清培养基培养细胞。
- 往96孔板每孔加入100μL染色工作液,384孔板每孔加入25μL染色工作液。
- 将染色反应板室温或37℃下避光孵育1小时。(孵育时间可以是15分钟到过夜,温育时间少于4小时我们得到了最佳结果)。
- 适当的温育时间取决于所使用的细胞类型和细胞浓度。每个实验都需要进行温育时间优化。
- 染色后不要洗细胞。
- 对于非粘附细胞,孵育后建议将细胞板离心,800转2分钟,以中断反应。
- 适当的温育时间取决于所使用的细胞类型和细胞浓度。每个实验都需要进行温育时间优化。
- 对于活细胞,在波长490/525nm通过FITC滤光片监测荧光强度,对于死细胞在波长540/620nm通过四乙基若丹明异硫氰酸盐(TRITC)监测荧光强度。
用流式细胞仪对细胞活力进行测定:- 用测试化合物根据特定时间处理细胞;
- 离心收集细胞达到每管1~5×105个Centrifuge the cells to get 1~5×105 cells/tube;
- 用500μL CytoCalcein Green/PI染色溶液悬浮细胞;
- 在室温或37℃下进行孵育10至30分钟,避光。
选做:用HHBS缓冲液或自备缓冲液冲洗细胞,用500μL的HHBS缓冲液重悬细胞达到每管1~5×105个。 - 用流式细胞仪监测Ex/Em = 490/525nm~620nm处荧光强度(使用FL1和FL2通道)。
- 用测试化合物根据特定时间处理细胞;

用试验化合物处理的细胞的荧光强度减去加生长培养基的空白孔的荧光强度。空白孔的背景荧光根据微量滴定板或生长培养基的不同而变化。
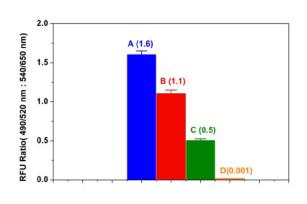
图1.细胞活力检测试剂盒测定皂素处理Jurkat细胞诱导Jurkat细胞死亡的效果。Jurkat细胞以每毫升2×106个细胞的细胞浓度分别通过0.5%皂素处理5分钟和未加皂素处理5分钟,然后离心细胞,吸去上清液,加入新鲜培养基。A为未经处理的细胞的100μL,B为50μL的未处理的和50μL的处理的细胞,C为75μL未经处理的细胞和25μL经处理的细胞,D为0.5%皂苷处理的细胞100μL,细胞铺于96孔黑色壁/透明底的多聚赖氨酸片板中。将细胞经CytoCalcein Green/PI染色溶液处理,每孔100μL,37℃孵育1小时。用BMG公司的NOVOstar测定波长为490/525nm和540/650nm的荧光强度。波长为490/525nm和540/650nm的荧光强度的比值即活细胞与死细胞的比值如图所示(n=6)
相关搜索:细胞活性检测试剂盒(双荧光染色),细胞活性检测试剂盒



